
Constituyentes químicos y actividad farmacológica del ajo (Allium sativum L.)

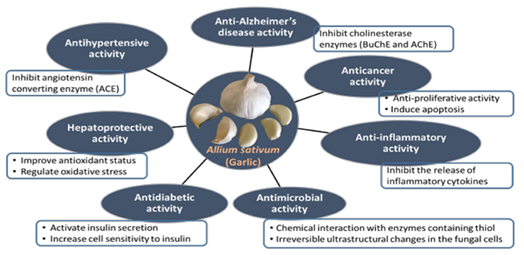
Las plantas medicinales se han usado desde la antigüedad para la atención de la salud humana en forma de medicinas tradicionales, especias y otros componentes alimenticios. El ajo (Allium sativum L.) es una planta herbácea aromática que se consume en todo el mundo como alimento y remedio tradicional para diversas enfermedades. Se ha informado que posee varias propiedades biológicas que incluyen actividades anticancerígenas, antioxidantes, antidiabéticas, renoprotectoras, antiateroscleróticas, antibacterianas, antifúngicas y antihipertensivas. A. sativum es rico en varios fitoconstituyentes que contienen azufre, como aliina, alicina, ajoenes, vinilditiinas y flavonoides como la quercetina. Los extractos y compuestos aislados de A. sativum se han evaluado para diversas actividades biológicas, incluidas actividades antibacterianas, antivirales, antifúngicas, antiprotozoarias, antioxidantes, antiinflamatorias y anticancerígenas, entre otras. Este articulo examina la composición fitoquímica, farmacocinética y actividades farmacológicas de los extractos de A. sativum, así como su principal componente activo, la alicina.
Las plantas medicinales son buena fuente de moléculas farmacológicamente activas. Recientemente, los antibióticos y la mayoría de las drogas en el mercado han mostrado síntomas no deseados y aparición de microorganismos patógenos resistentes, efectos tóxicos relacionados con los medicamentos, por lo tanto, se ha prestado mucha atención a los extractos de hierbas y moléculas farmacológicamente activas extraídas de diferentes especies de plantas que se utilizan en la medicina tradicional. Se ha informado que muchas especies de plantas ejercen propiedades farmacológicas debido a sus fitoconstituyentes como los glucósidos, alcaloides, saponinas, esteroides, flavonoides, taninos y terpenoides (por ejemplo, monoterpenos, diterpenos y sesquiterpenos). Hoy en día, el ochenta por ciento de la población mundial depende de las medicinas tradicionales como atención primaria de salud.

El ajo es una especia herbácea anual aromática y una de las hierbas más antiguas que se han utilizado desde la antigüedad como medicina tradicional. Se utiliza como remedio contra varias enfermedades comunes como el resfriado, la gripe, las mordeduras de serpientes y la hipertensión. Sus componentes activos reducen el riesgo de diabetes y enfermedades cardiovasculares, protegen contra las infecciones mediante la activación del sistema inmunitario y tienen propiedades antimicrobianas, antimicóticas, antienvejecimiento y antienvejecimiento, que se confirman con datos epidemiológicos de estudios clínicos en humanos. El ajo también se ha utilizado para cocinar como especia que puede dar sabor a los alimentos durante el proceso de cocción. Además se han identificado otros usos terapéuticos que incluyen el tratamiento de trastornos pulmonares, tos ferina, trastornos estomacales, resfriado, dolor de oído y ayuda a prevenir enfermedades cardiovasculares. Se ha informado que el ajo crudo y sus productos transformados contienen varios compuestos de azufre que se han incluido en varios tipos de preparaciones.
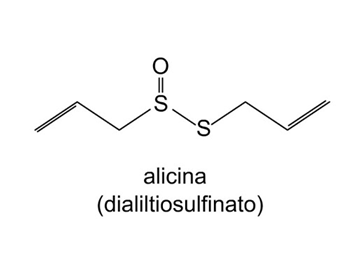
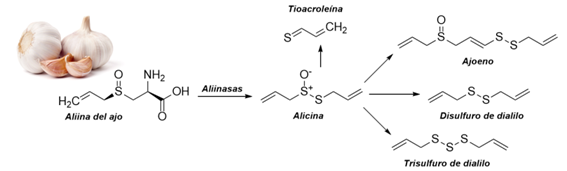
La alicina [S- (2-propenil) -2-propeno-1-sulfinotioato], el compuesto del ajo que contiene azufre más biológicamente activo, es responsable de su olor y sabor. La aliina (S-alil-L-cisteína sulfóxido) es el principal precursor de la alicina, que representa alrededor del 70% del total de tiosulfonatos existentes en los dientes de ajo aplastados. La alicina es un compuesto de azufre soluble en lípidos, que se puede dañar fácilmente al cocinar. También se han informado diversas actividades farmacológicas para los extractos y compuestos aislados de ajo.
Los componentes químicos del Ajo
Los bulbos de ajo contienen cientos de compuestos fitoquímicos que incluyen compuestos que contienen azufre (ver Tabla 1) tales como ajoenos (E-ajoeno, Z-ajoeno), tiosulfonatos (alicina), vinilditiinas (2-vinil- (4H) -1,3-diti vinil- (4H) -1,2-ditiina), sulfuros (disulfuro de dialilo (DADS), trisulfuro de dialilo (DATS)) y otros que representaron el 82% del contenido total de azufre en ajo. S-propil-cisteína-sulfóxido (PCSO), alicina y S-metilcisteína-sulfóxido (MCSO) son las principales moléculas odoríferas de los homogenados de ajo recién molido. PCSO puede producir más de cincuenta metabolitos dependiendo del contenido de agua y la temperatura, la enzima alinasa puede actuar sobre la mezcla de MCSO, PCSO y aliina para producir otras moléculas, como el alil metano tiosulfatos, metil metanostonato y otros tiosulfatos correspondientes (R-S-S-R0), por los cuales R y R0 son grupos alilo, propilo y metilo.
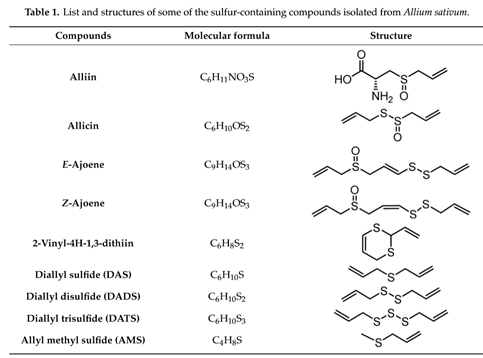
Las formulaciones de ajo consisten en varios compuestos organosulfurados, N-acetilcisteína (NAC), S-alil-cisteína (SAC) [33] y S-aliado-mercaptocisteína (SAMC), que se derivan de la aliina. En particular, el SAC tiene capacidades antioxidantes, antiinflamatorias, redox, proenergéticas, antiapoptóticas y de señalización, mientras que el SAMC muestra una actividad anticancerosa al prevenir la multiplicación de las células cancerosas. La alicina (tiosulfonato de alilo) es un tioéster de ácido sulfénico y su efecto farmacológico se atribuye a su actividad antioxidante, así como a su interacción con las proteínas que contienen tiol.
Actividades farmacológicas del ajo y sus compuestos relacionados
Actividad antibacteriana
Se ha reportado gran actividad antimicrobiana del ajo (relacionada al compuesto alicina) contra una gran variedad de microorganismos, incluidas las bacterias resistentes a los antibióticos, Gram-positivas y Gram-negativas, como Shigella, Escherichia coli, Staphylococcus aureus, Pseudomonas aeruginosa, Klebsiella aerogenes, Vibrio, micobacterias, Proteus vulgaris y Enterococcus faecalis. La actividad antimicrobiana de la alicina se debe a su interacción química con enzimas que contienen tiol, por ejemplo, tiorredoxinreductasa, ARN polimerasa, andalcoholdehidrogenasa por oxidación de la proteincisteína o residuos de glutatión en condiciones fisiológicas.
Actividad antifúngica
Los extractos de ajo mostraron un efecto fungicida de amplio espectro contra una amplia gama de hongos, incluyendo especies de Candida, Torulopsis, Trichophyton, Cryptococcus, Aspergillus, Trichosporon y Rhodotorula. Recientemente, se descubrió que el extracto de ajo inhibía la germinación y el crecimiento de Meyerozyma guilliermondii y Rhodotorula mucilaginosa. Otro estudio informó la actividad antifúngica de varios extractos de A. sativum, contra hongos patógenos humanos Trichophytonverrucosum, T.mentagrophytes, T.rubrum, Botrytiscinerea, especies de Candida, Epidermophyton fl occosum, Aspergillus niger, A. fl avus, Rhopus, Rhopus stolonifera, Microsporum gypseum, M. audouinii, Alternaria alternate, Neofabraea alba y Penicillium expansum. El extracto de ajo actuó al afectar la pared celular fúngica y causar cambios ultraestructurales irreversibles en las células fúngicas, lo que condujo a la pérdida de integridad estructural y afectó la capacidad de germinación. Estos cambios en el contenido citoplasmático conducen a daños en los núcleos y orgánulos celulares que finalmente conducen a la muerte celular.

Actividad antiprotozoaria
Varios estudios informaron la actividad antiprotozoaria de los extractos de ajo y sus fitoquímicos contra varios parásitos protozoarios. Por ejemplo, un estudio in vitro reveló que los extractos acuosos, etanólicos y de diclorometano de A. sativum exhibieron actividad antihelmíntica contra Haemonchus contortus y el extracto etanólico fue el más efectivo, mientras que el extracto acuoso de ajo mostró una potente actividad contra Trichuris muris y Angiostrongylus cantonensis. Abdel-Hafeez y col. mostró que el extracto de ajo inhibió el crecimiento de Blastocystis spp. in vivo y esta actividad atribuida a que los extractos de ajo contienen varios fitoquímicos, por ejemplo, los tiosulfonatos son uno de los compuestos bioactivos que poseen actividad antibacteriana relacionada con la inhibición de las enzimas tiol que se presenta en varios microorganismos. La alicina también actúa previniendo el ARN del parásito, así como la síntesis de ADN y proteínas.

Actividad antiviral
La actividad antiviral de los extractos de ajo se ha evaluado contra la influenza B, el rinovirus humano tipo 2, el citomegalovirus humano (HCMV), el virus de la parainfluenza tipo 3, el herpes simple tipo 1 y 2, el virus vaccinia y el virus de la estomatitis vesicular.
Actividad anticancerígena
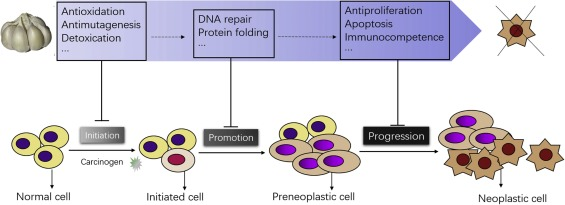
Se descubrió que el extracto de ajo es un anticancerígeno efectivo y altamente específico en comparación con 33 extractos vegetales contra diferentes células cancerosas. Shang y col. informaron que los mecanismos anticancerígenos de los extractos de ajo se atribuyeron a la inhibición del crecimiento y la proliferación celular, la regulación del metabolismo carcinógeno, la estimulación de la apoptosis, la prevención de la angiogénesis, la invasión y la migración y, por lo tanto, la reducción de los efectos negativos del agente anticancerígeno. En 1960, se informó que las células tumorales fueron destruidas cuando se incubaron en una solución de alicina. Se informó que la alicina aislada del ajo suprime la metástasis del cáncer colorrectal al mejorar la función inmune y prevenir la formación de vasos tumorales. Además, en el tratamiento del cáncer de páncreas mejora el silenciamiento génico y restringe la proliferación de células cancerosas. Zhang et al. reveló que la alicina puede prevenir la proliferación y la inducción de la proliferación de células MGC 803 en las células del cáncer gastrointestinal, que pueden lograrse a través de la mejora de la expresión de p38. En particular, Fleischauer y Arab informaron que la ingesta continua de ajo podría disminuir los diferentes tipos de propagación del cáncer, tales como pulmón, colon, estómago, mama y próstata. El Z-ajoeno ha mostrado actividades antiproliferativas contra los diferentes tipos de cáncer. Se descubrió que estimula la apoptosis en las células leucémicas humanas al promover la producción de peróxido, actividades similares a caspasa-3 y caspasa-8.
Actividad contra la enfermedad de Alzheimer
La enfermedad de Alzheimer (EA) es la principal causa de demencia en los ancianos con trastornos neurodegenerativos y cerebrovasculares. La acetilcolinesterasa (AChE) es la enzima principal que convierte la acetilcolina (ACh) en el sistema nervioso en acetato y colina. La reducción de ACh en el sistema nervioso central ha estado involucrado en la fisiopatología notada en EA. Sorprendentemente, el aceite de los bulbos de ajo suprimió la actividad de AChE del sinaptosoma de la corteza cerebral y exhiben propiedades antioxidantes, inhibiendo así la actividad de AChE.
Haideretal. informó que la ingesta prolongada de ajo está relacionada con la promoción de la función de memoria mediante la determinación de los niveles del neurotransmisor, la serotonina. El consumo in vivo de extractos de A. sativum ha demostrado que mejora la memoria al eliminar los radicales libres que causan daño oxidativo e inhiben la enzima AChE. Se observó que la alicina inhibe las enzimas AChE y butirilcolinesterasa (BuChE) (enzimas que descomponen el neurotransmisor colina) que aumentan sucesivamente la concentración de ACh en el cerebro. Por lo tanto, retrasó el deterioro cognitivo y la demencia.
También se ha reportado que el ajo tiene efectos inmunomoduladores, antiinflamatorios y antioxidantes, y esto se centró en el efecto conocido del ajo y sus compuestos relacionados principalmente a la alicina en la inhibición de las enzimas AChE y BuChE. Terapia de combinación de alicina con inhibidores de colinesterasa (CHEI) que incluye; La rivastigmina, la galantamina y el donepezilo son ahora los más utilizados para el tratamiento de la EA, ya que tienen la capacidad de corregir la deficiencia colinérgica observada con la EA. Los antioxidantes como el tocoferol, la selegilina y el ácido ascórbico (vitamina C) fueron considerados como una posible terapia preventiva para EA. Recientemente, se ha demostrado que la alicina tiene un efecto protector sobre el daño neuronal isquémico o traumático controlado por la apoptosis y las vías de estrés oxidativo.

Efecto sobre la dislipidemia
Se sabe que la dislipidemia es la principal causa de infarto de miocardio y enfermedades cardiovasculares definidas por altos niveles de triglicéridos (TG), LDL, colesterol total (TC) y bajo nivel de HDL. Se ha investigado las preparaciones de ajo y sus fitoquímicos al tratar la hipercolesterolemia al prevenir el colesterol y al inhibir la oxidación de las lipoproteínas de baja densidad (LDL y HDL). Además, el ajo reduce el nivel de colesterol estimulando la excreción de esteroides ácidos y neutros.

Efecto sobre la diabetes mellitus
Extracto de ajo presento un efecto antidiabético en un estudio con ratones y conejos diabéticos. Otro estudio clínico examinó el efecto antidiabético de la administración de píldoras de ajo a 900 mg / día en pacientes con diabetes tipo II e hiperlipidemia e informaron que las píldoras de ajo disminuyen el colesterol, los lípidos en suero y el azúcar en sangre en ayunas. Además, el disulfuro de alil propilo, la alicina, el sulfóxido de cisteína y el sulfóxido de cisteína S-alilo disminuyeron el nivel de glucosa en la sangre al prevenir la activación de la insulina causada por el hígado, mejorando la secreción de insulina de células beta pancreáticas. Zhai y col. También se informó que el aceite de ajo disminuye la amilasa sérica, el aspartato sérico y las transferasas de alanina y la fosfatasa alcalina en ratas diabéticas.
Efecto sobre la obesidad
La obesidad es el problema de salud más común que puede conducir a muchas dolencias como hipertensión, dislipidemia, trastornos cardiovasculares y síndrome metabólico. Se ha reportado que el uso de extracto de ajo produce una reducción del peso corporal y la masa de tejido adiposo y mejora los perfiles de lípidos en plasma en ratones con obesidad. Además, Lee et al. revelaron que el efecto antiobesidad de los extractos de ajo se ha atribuido a la estimulación de la proteína quinasa activada por AMP (AMPK), así como al aumento de la termogénesis y la disminución de la expresión de múltiples genes relacionadas a la adipogénesis. Se encontró que el ajoene aislado de los extractos de ajo estimula la apoptosis, disminuye la acumulación de grasa en los adipocitos 3T3-L1 y disminuye drásticamente el aumento de peso corporal en ratones sin afectar la cantidad de ingesta de alimentos.
La actividad antihipertensiva
Varshney Budo informó la función esencial del ajo en el control de los factores de riesgo cardiovascular, ya que se sabe que disminuye significativamente la presión arterial sistólica y diastólica. Las formulaciones de ajo se han usado ampliamente para inhibir y aliviar trastornos cardiovasculares como hipertensión, arritmia, trombosis, hiperlipidemia y aterosclerosis. Varios estudios experimentales y en humanos informaron el efecto antihipertensivo de los extractos de ajo y sus moléculas bioactivas derivadas.
El mecanismo principal del efecto antihipertensivo de los extractos de ajo es que el ajo contiene muchas moléculas de azufre activas que se ha demostrado que estimulan los factores que constriñen y relajan el endotelio y conducen a una presión arterial más baja. También se ha demostrado que el ajo estimula la producción de óxido nítrico (NO) y sulfuro de hidrógeno (H2S) que finalmente conduce a la vasodilatación. Por lo tanto, el ajo se usa como planta medicinal para controlar la presión arterial en todo el mundo. Además, el ajo exhibió un papel significativo en la inhibición de la trombosis, así como en la adhesión o agregación plaquetaria en humanos. Además, se ha informado que el ajo reduce el riesgo de viscosidad plasmática, angina inestable y trastornos oclusivos arteriales periféricos y aumenta la elasticidad de los vasos sanguíneos y la perfusión de los capilares. Se informó que la gamma-glutamilcisteína aislada del ajo disminuye la presión sanguínea al inhibir la enzima convertidora de angiotensina (ECA).

Conclusiones
Esta revisión se centró en los componentes químicos y las actividades farmacológicas de A. sativum. Los compuestos que contienen azufre, como la aliina, la alicina, los ajoenos, las vinilditiinas y los sulfuros, son los principales componentes de los extractos de A. sativum. Se informó que los extractos y compuestos aislados de A. sativum poseen varias propiedades biológicas que incluyen actividades anticancerígenas, antioxidantes, antidiabéticas, renoprotectoras, antiateroscleróticas, antibacterianas, antifúngicas, antiprotozoarias y antihipertensivas. El ajo también es conocido por tener actividades inmunomoduladoras y antiinflamatorias. La alicina, la sustancia activa del ajo, puede inducir agitación, especialmente si se administra en dosis altas. Además de eso, se ha informado que A. sativum afecta la farmacocinética de los fármacos antirretrovirales, así como los anticoagulantes. Por lo tanto, se debe tener debidamente en cuenta al usar el ajo como medicamento para el tratamiento de diferentes enfermedades.
References
- . Ríos, J.L.; Recio, M.C. Medicinal plants and antimicrobial activity. J. Ethnopharmacol. 2005, 100, 80–84. [CrossRef] [PubMed]
- Beshbishy, A.M.; Batiha, G.E.S.; Adeyemi, O.S.; Yokoyama, N.; Igarashi, I. Inhibitory effects of methanolic Olea europaea and acetonic Acacia laeta on the growth of Babesia and Theileria. Asian Pac. J. Trop. Med. 2019, 12, 425–434.
- Batiha, G.E.S.; Beshbishy, A.A.; Tayebwa, D.S.; Shaheen, M.H.; Yokoyama, N.; Igarashi, I. Inhibitory effects of Syzygium aromaticum and Camellia sinensis methanolic extracts on the growth of Babesia and Theileria parasites. Ticks Tick Borne Dis. 2019, 10, 949–958. [CrossRef] [PubMed]
- Batiha, G.E.S.; Beshbishy, A.A.; Adeyemi, O.S.; Nadwa, E.; Rashwan, E.; Yokoyama, N.; Igarashi, I. Safety and efficacy of hydroxyurea and eflornithine against most blood parasites Babesia and Theileria. PLoS ONE 2020, 15, e0228996.
- Batiha, G.-S.; Beshbishy, A.M.; Alkazmi, L.M.; Adeyemi, O.S.; Nadwa, E.H.; Rashwan, E.K.; El-Mleeh, A.; Igarashi, I. Gas chromatography-mass spectrometry analysis, phytochemical screening and antiprotozoal effects of the methanolic Viola tricolor and acetonic Laurus nobilis extracts. BMC Complement. Altern. Med. 2020, in press. [CrossRef]
- Batiha, G.E.S.; Beshbishy, A.M.; Tayebwa, D.S.; Adeyemi, O.S.; Shaheen, H.; Yokoyama, N.; Igarashi, I. Evaluation of the inhibitory effect of ivermectin on the growth of Babesia and Theileria parasites in vitro and in vivo. Trop. Med. Health 2019, 47, 42. [CrossRef]
- Essawi, T.; Srour, M. Screening of some Palestinian medicinal plants for antibacterial activity. J. Ethnopharmacol. 2000, 70, 343–349. [CrossRef]
- Batiha, G.E.S.; Beshbishy, A.M.; Tayebwa, D.S.; Adeyemi, O.S.; Shaheen, H.; Yokoyama, N.; Igarashi, I. The effects of trans-chalcone and chalcone 4 hydrate on the growth of Babesia and Theileria. PLoS Negl. Trop. Dis. 2019, 13, e0007030. [CrossRef]
- Beshbishy, A.M.; Batiha, G.E.; Yokoyama, N.; Igarashi, I. Ellagic acid microspheres restrict the growth of Babesia and Theileria in vitro and Babesia microti in vivo. Parasites Vectors 2019, 12, 269. [CrossRef]
- Batiha, G.E.S.; Beshbishy, A.A.; Tayebwa, D.S.; Adeyemi, O.S.; Yokoyama, N.; Igarashi, I. Anti-piroplasmic potential of the methanolic Peganum harmala seeds and ethanolic Artemisia absinthium leaf extracts. J. Protozool. Res. 2019, 29, 8–27.
- Batiha, G.-S.; Beshbishy, A.M.; Adeyemi, O.S.; Nadwa, E.H.; Rashwan, E.M.; Alkazmi, L.M.; Elkelish, A.A.; Igarashi, I. Phytochemical screening and antiprotozoal effects of the methanolic Berberis vulgaris and acetonic Rhus coriaria extracts. Molecules 2020, 25, 550. [CrossRef] [PubMed]
- Dorman, H.J.; Deans, S.G. Antimicrobial agents from plants: Antibacterial activity of plant volatile oils. J. Appl. Microbiol. 2000, 88, 308–316. [CrossRef] [PubMed]
- Batiha, G.-S.; Alkazmi, L.M.; Nadwa, E.H.; Rashwan, E.K.; Beshbishy, A.M. Physostigmine: A plant alkaloid isolated from Physostigma venenosum: A review on pharmacokinetics, pharmacological and toxicological activities. J. Drug Deliv. Ther. 2020, 10, 187–190. [CrossRef]
- Bakkali, F.; Averbeck, S.; Averbeck, D.; Idaomar, M. Biological effects of essential oils—A review. Food Chem. Toxicol. 2008, 46, 446–475. [CrossRef] [PubMed]
- Batiha, G.-S.; Alkazmi, L.M.; Wasef, L.G.; Beshbishy, A.M.; Nadwa, E.H.; Rashwan, E.K. Syzygium aromaticum L. (Myrtaceae): Traditional uses, bioactive chemical constituents, pharmacological and toxicological activities. Biomolecules 2020, 10, 202. [CrossRef] [PubMed]
- Ayaz, E.; Alposy, H.C. Garlic (Allium sativum) and traditional medicine. Turkiye Parazitolojii Derg. 2007, 31, 145–149.
- Badal, D.S.; Dwivedi, A.K.; Kumar, V.; Singh, S.; Prakash, A.; Verma, S.; Kumar, J. Effect of organic manures and inorganic fertilizers on growth, yield and its attributing traits in garlic (Allium sativum L.). J. Pharmacogn. Phytochem. 2019, 8, 587–590.
- Barnes, J.; Anderson, L.A.; Phillipson, J.D. Herbal Medicines, 2nd ed.; Pharmaceutical Press: London, UK, 2002; Volume 14.
- Rahman, K. Historical perspective on garlic and cardiovascular disease. J. Nutr. 2001, 131, 977S–979S. [CrossRef]
- 20.Mathew, B.; Biju, R. Neuroprotective e ffects of garlic a review. Libyan J. Med. 2008, 3, 23–33.
- Al-Jaber, N.A.; Awaad, A.S.; Moses, J.E. Review some antioxidant plants growing in Arab world. J. Saudi Chem. Soc. 2011, 15, 293–307. [CrossRef]
- Wanwimolruk, S.; Prachayasittikul, V. Cytochrome P450 enzyme mediated herbal drug interactions (Part 1). EXCLI J. 2014, 13, 347–391. [PubMed]
- Slusarenko, A.J.; Patel, A.; Portz, D. Control of plant diseases by natural products: Allicin from garlic as a case study. Eur. J. Plant Pathol. 2008, 121, 313. [CrossRef]
- Rahman, M.S. Allicin and other functional active components in garlic: Health benefits and bioavailability. Int. J. Food Prop. 2007, 10, 245–268. [CrossRef]
- Kaye, A.D.; De Witt, B.J.; Anwar, M.; Smith, D.E.; Feng, C.J.; Kadowitz, P.J.; Nossaman, B.D. Analysis of responses of garlic derivatives in the pulmonary vascular bed of the rat. J. Appl. Physiol. 2000, 89, 353–358. [CrossRef] [PubMed]
- Lawson, L.D.; Gardner, C.D. Composition, stability, and bioavailability of garlic products used in a clinical trial. J. Agric. Food Chem. 2005, 53, 6254–6261. [CrossRef] [PubMed]
- Rishton, G.M. Natural products as a robust source of new drugs and drug leads: Past successes and present day issues. Am. J. Cardiol. 2008, 101, S43–S49. [CrossRef]
- Batiha, G.E.S.; Beshbishy, A.A.; Tayebwa, D.S.; Shaheen, M.H.; Yokoyama, N.; Igarashi, I. Inhibitory effects of Uncaria tomentosa bark, Myrtus communis roots, Origanum vulgare leaves and Cuminum cyminum seeds extracts against the growth of Babesia and Theileria in vitro. Jpn. J. Vet. Parasitol. 2018, 17, 1–13.
- Sobolewska, D.; Podolak, I.; Makowska-Wa˛s, J. Allium ursinum: Botanical, phytochemical and pharmacological overview. Phytochem. Rev. 2015, 14, 81–97. [CrossRef]
- Al-Snafi, A. Pharmacological effects of Allium species grown in Iraq. An overview. Int. J. Pharm. Health Care Res. 2013, 1, 132–147.
- Zeng, Y.; Li, Y.; Yang, J.; Pu, X.; Du, J.; Yang, X.; Yang, T.; Yang, S. Therapeutic role of functional components in Alliums for preventive chronic disease in human being. Evid. Based Complement. Altern. Med. 2017, 2017, 9402849. [CrossRef]
- Souza, G.A.; Ebaid, G.X.; Seiva, F.R.; Rocha, K.H.; Galhardi, C.M.; Mani, F.; Novelli, E.L. N-acetylcysteine an Allium plant compound improves high-sucrose diet-induced obesity and related effects. Evid. Based Complement. Altern. Med. 2011, 2011, 643269. [CrossRef] [PubMed]
- Asdaq, S.M.B.; Inamdar, M.N. Pharmacodynamic and pharmacokinetic interactions of propranolol with garlic (Allium sativum) in rats. Evid. Based Complement. Altern. Med. 2011, 2011, 824042. [CrossRef] [PubMed]
- Tran, G.B.; Dam, S.M.; Le, N.T.T. Amelioration of single clove black garlic aqueous extract on dyslipidemia and hepatitis in chronic carbon tetrachloride intoxicated Swiss Albino mice. Int. J. Hepatol. 2018, 2018, 9383950. [CrossRef] [PubMed]
- Liu, Y.; Yan, J.; Han, X.; Hu, W. Garlic-derived compound S-allylmercaptocysteine (SAMC) is active against anaplastic thyroid cancer cell line 8305C (HPACC). Technol. Health Care 2015, 23, S89–S93. [CrossRef]
- Cao, X.; Cao, L.; Ding, L.; Bian, J.S. A new hope for a devastating disease: Hydrogen sulfide in Parkinson’s disease. Mol. Neurobiol. 2017, 55, 3789–3799. [CrossRef]
- Miron, T.; Rabinkov, A.; Mirelman, D.; Wilchek, M.; Weiner, L. The mode of action of allicin: Its ready permeability through phospholipid membranes may contribute to its biological activity. Biochim. Biophys. Acta 2000, 1463, 20–30. [CrossRef]
- Borlinghaus, J.; Albrecht, F.; Gruhlke, M.C.; Nwachukwu, I.D.; Slusarenko, A.J. Allicin: Chemistry and biological properties. Molecules 2014, 19, 12591–12618. [CrossRef]
- Shimon, L.J.; Rabinkov, A.; Shin, I.; Miron, T.; Mirelman, D.; Wilchek, M.; Frolow, F. Two structures of alliinase from Allium sativum L.: Apo form and ternary complex with aminoacrylate reaction intermediate covalently bound to the PLP cofactor. J. Mol. Biol. 2007, 366, 611–625. [CrossRef]
- De Rooij, B.M.; Boogaard, P.J.; Rijksen, D.A.; Commandeur, J.N.; Vermeulen, N.P. Urinary excretion of N-acetyl-S-allyl-L-cysteine upon garlic consumption by human volunteers. Arch. Toxicol. 1996, 70, 635–639. [CrossRef]
- Freeman, F.; Kodera, Y. Garlic chemistry: Stability of S-(2-propenyl)-2-propene-1-sulfinothioate (Allicin) in blood, solvents, and simulated physiological fluids. J. Agric. Food Chem. 1995, 43, 2332–2338. [CrossRef]
- Ilic´, D.P.; Stojanovic´, S.; Najman, S.; Nikolic´, V.D.; Stanojevic´, L.P.; Tacˇic´, A.; Nikolic´, L.B. Biological evaluation of synthesized allicin and its transformation products obtained by microwaves in methanol: Antioxidant activity and effect on cell growth. Biotechnol. Biotechnol. Equip. 2015, 29, 189–194. [CrossRef] [PubMed]
- Thomson, M.; Ali, M. Garlic [Allium sativum]: A review of its potential use as an anti-cancer agent. Curr. Cancer Drug Targets 2003, 3, 67–81. [CrossRef] [PubMed]
- Kuda, T.; Iwai, A.; Yano, T. Effect of red pepper Capsicum annuum var. conoides and garlic Allium sativum on plasma lipid levels and cecal microflora in mice fed beef tallow. Food Chem. Toxicol. 2004, 42, 1695–1700. [CrossRef] [PubMed]
- Tesfaye, A.; Mengesha, W. Traditional uses, phytochemistry and pharmacological properties of garlic (Allium Sativum) and its biological active compounds. Int. J. Sci. Res. Eng. Technol. 2015, 1, 142–148.
- Rahman, K.; Lowe, G.M. Garlic and cardiovascular disease: A critical review. J. Nutr. 2006, 136, 736s–740s. [CrossRef]
- Davis, S.R. An overview of the antifungal properties of allicin and its breakdown products-the possibility of a safe and effective antifungal prophylactic. Mycoses 2005, 48, 95–100. [CrossRef]
- Ross, Z.M.; O’Gara, E.A.; Hill, D.J.; Sleightholme, H.V.; Maslin, D.J. Antimicrobial properties of garlic oil against human enteric bacteria: Evaluation of methodologies and comparisons with garlic oil sulfides and garlic powder. Appl. Environ. Microbiol. 2001, 67, 475–480. [CrossRef]
- Cutler, R.; Wilson, P. Antibacterial activity of a new, stable, aqueous extract of allicin against methicillin-resistant Staphylococcus aureus. Br. J. Biomed. Sci. 2004, 61, 71–74. [CrossRef]
- Wallock-Richards, D.; Doherty, C.J.; Doherty, L.; Clarke, D.J.; Place, M.; Govan, J.R.; Campopiano, D.J. Garlic revisited: Antimicrobial activity of allicin-containing garlic extracts against Burkholderia cepacia complex. PLoS ONE 2014, 9, e112726. [CrossRef]
- Mikaili, P.; Maadirad, S.; Moloudizargari, M.; Aghajanshakeri, S.; Sarahroodi, S. Therapeutic uses and pharmacological properties of garlic, shallot, and their biologically active compounds. Iran. J. Basic Med. Sci. 2013, 16, 1031–1048.
- Meriga, B.; Mopuri, R.; MuraliKrishna, T. Insecticidal, antimicrobial and antioxidant activities of bulb extracts of Allium sativum. Asian Pac. J. Trop. Med. 2012, 5, 391–395. [CrossRef]
- Shokrzadeh, M.; Ebadi, A.G. Antibacterial effect of garlic (Allium sativum L.) on Staphylococcus aureus. Pak. J. Biol. Sci. 2006, 9, 1577–1579.
- Gruhlke, M.C.; Nwachwukwu, I.; Arbach, M.; Anwar, A.; Noll, U.; Slusarenko, A.J. Allicin from garlic, effective in controlling several plant diseases, is a reactive sulfur species (RSS) that pushes cells into apoptosis. In Proceedings of the Modern fungicides and antifungal compounds VI. 16th International Reinhardsbrunn Symposium, Friedrichroda, Germany, 25–29 April 2010.
- Pârvu, M.; Mo¸t, C.A.; Pârvu, A.E.; Mircea, C.; Stoeber, L.; Ros¸ca-Casian, O.; T¸ igu, A.B. Allium sativum extract chemical composition, antioxidant activity and antifungal effect against Meyerozyma guilliermondii and Rhodotorula mucilaginosa causing onychomycosis. Molecules 2019, 24, 3958. [CrossRef]
- Fufa, B. Anti-bacterial and anti-fungal properties of garlic extract (Allium sativum): A review. Microbiol. Res. J. Int. 2019, 28, 1–5. [CrossRef]
- Pai, S.T.; Platt, M.W. Antifungal effects of Allium sativum (garlic) extract against the Aspergillus species involved in otomycosis. Lett. Appl. Microbiol. 1995, 20, 14–18. [CrossRef] [PubMed]
- Zhen, H.; Fang, F.; Ye, D.Y.; Shu, S.N.; Zhou, Y.F.; Dong, Y.S.; Nie, X.C.; Li, G. Experimental study on the action of allitridin against human cytomegalovirus in vitro: Inhibitory effects on immediate-early genes. Antiviral Res. 2006, 72, 68–74. [CrossRef]
- Abdel-Ghaffar, F.; Semmler, M.; Al-Rasheid, K.A.; Strassen, B.; Fischer, K.; Aksu, G.; Klimpel, S.; Mehlhorn, H. The effects of different plant extracts on intestinal cestodes and on trematodes. Parasitol. Res. 2011, 108, 979–984. [CrossRef]
- Abdel-Hafeez, E.H.; Ahmad, A.K.; Kamal, A.M.; Abdellatif, M.Z.; Abdelgelil, N.H. In vivo antiprotozoan effects of garlic (Allium sativum) and ginger (Zingiber officinale) extracts on experimentally infected mice with Blastocystis spp. Parasitol. Res. 2015, 114, 3439–3444. [CrossRef]
- Gallwitz, H.; Bonse, S.; Martinez-Cruz, A.; Schlichting, I.; Schumacher, K.; Krauth-Siegel, R.L. Ajoene is an inhibitor and subversive substrate of human glutathione reductase and Trypanosoma cruzi trypanothione reductase: Crystallographic, kinetic, and spectroscopic studies. J. Med. Chem. 1999, 42, 364–372. [CrossRef]
- Hazaa, I.K.K.; Al-Taai, N.A.; Khalil, N.K.; Zakri, A.M.M. Efficacy of garlic and onion oils on murin experimental Cryptosporidium parvum infection. Al-Anbar J. Vet. Sci. 2016, 9, 69–74.
- Gruhlke, M.C.; Nicco, C.; Batteux, F.; Slusarenko, A.J. The effects of allicin, a reactive sulfur species from garlic, on a selection of mammalian cell lines. Antioxidants 2016, 6, 1. [CrossRef] [PubMed]
- 64. Sawai, T.; Itoh, Y.; Ozaki, H.; Isoda, N.; Okamoto, K.; Kashima, Y.; Kawaoka, Y.; Takeuchi, Y.; Kida, H.; Ogasawara, K. Induction of cytotoxic T-lymphocyte and antibody responses against highly pathogenic avian influenza virus infection in mice by inoculation of a pathogenic H5N1 influenza virus particles inactivated with formalin. Immunology 2008, 124, 155–165. [CrossRef] [PubMed]
- Jang, H.J.; Lee, H.J.; Yoon, D.K.; Ji, D.S.; Kim, J.H.; Lee, C.H. Antioxidant and antimicrobial activities of fresh garlic and aged garlic by-products extracted with different solvents. Food Sci. Biotechnol. 2017, 27, 219–225. [CrossRef]
- Liu, J.; Guo, W.; Yang, M.L.; Liu, L.X.; Huang, S.X.; Tao, L.; Zhang, F.; Liu, Y.S. Investigation of the dynamic changes in the chemical constituents of Chinese “laba” garlic during traditional processing. RSC Adv. 2018, 8, 41872–41883. [CrossRef]
- Chen, Y.; Sun, J.; Dou, C.; Li, N.; Kang, F.; Wang, Y.; Cao, Z.; Yang, X.; Dong, S. Alliin attenuated RANKL-induced osteoclastogenesis by scavenging reactive oxygen species through inhibiting Nox1. Int. J. Mol. Sci. 2016, 17, 1516. [CrossRef] [PubMed]
- Shang, A.; Cao, S.Y.; Xu, X.Y.; Gan, R.Y.; Tang, G.Y.; Corke, H.; Mavumengwana, V.; Li, H.B. Bioactive compounds and biological functions of garlic (Allium sativum L.). Foods 2019, 8, 246. [CrossRef] [PubMed]
- Abdel-Daim, M.M.; Shaheen, H.M.; Abushouk, A.I.; Toraih, E.A.; Fawzy, M.S.; Alansari, W.S.; Aleya, L.; Bungau, S. Thymoquinone and diallyl sulfide protect against fipronil-induced oxidative injury in rats. Environ. Sci. Pollut. Res Int. 2018, 25, 23909–23916. [CrossRef]
- Ahmad, T.A.; El-Sayed, B.A.; El-Sayed, L.H. Development of immunization trials against Eimeria spp. Trials Vaccinol. 2016, 5, 38–47. [CrossRef]
- Hobauer, R.; Frass, M.; Gmeiner, B.; Kaye, A.D.; Frost, E.A. Garlic extract (Allium sativum) reduces migration of neutrophils through endothelial cell monolayers. Middle East J. Anaesthesiol. 2000, 15, 649–658.
- Gu, X.; Wu, H.; Fu, P. Allicin attenuates inflammation and suppresses HLA-B27 protein expression in ankylosing spondylitis mice. BioMed Res. Int. 2013, 2013, 171573. [CrossRef]
- Jeong, Y.Y.; Ryu, J.H.; Shin, J.H.; Kang, M.J.; Kang, J.R.; Han, J.; Kang, D. Comparison of anti-Oxidant and anti-Inflammatory effects between fresh and aged black garlic extracts. Molecules 2016, 21, 430. [CrossRef] [PubMed]
- You, B.R.; Yoo, J.M.; Baek, S.Y.; Kim, M.R. Anti-inflammatory effect of aged black garlic on 12-O-tetradecanoylphorbol-13-acetate-induced dermatitis in mice. Nutr. Res. Pract. 2019, 13, 189–195. [CrossRef] [PubMed]
- Sela, U.R.; Ganor, S.; Hecht, I.; Brill, A.; Miron, T.; Rabinkov, A.; Wilchek, M.; Mirelman, D.; Lider, O.; Hershkoviz, R. Allicin inhibits SDF-1α-induced T cell interactions with fibronectin and endothelial cells by down-regulating cytoskeleton rearrangement, Pyk-2 phosphorylation and VLA-4 expression. Immunology 2004, 111, 391–399. [CrossRef] [PubMed]
- Abdel-Daim, M.M.; Abushouk, A.I.; Bungău, S.G.; Bin-Jumah, M.; El-Kott, A.F.; Shati, A.A.; Aleya, L.; Alkahtani, S. Protective effects of thymoquinone and diallyl sulphide against malathion-induced toxicity in rats. Environ. Sci. Pollut. Res. 2020, 1–8. [CrossRef]
- Jin, P.; Kim, J.A.; Choi, D.Y.; Lee, Y.J.; Jung, H.S.; Hong, J.T. Anti-inflammatory and anti-amyloidogenic effects of a small molecule, 2,4-bis(p-hydroxyphenyl)-2-butenal in Tg2576 Alzheimer’s disease mice model. J. Neuroinflamm. 2013, 10, 767. [CrossRef]
- Li, Z.; Le, W.; Cui, Z. A novel therapeutic anticancer property of raw garlic extract via injection but not ingestion. Cell Death Discov. 2018, 4, 108. [CrossRef]
- Chhabria, S.V.; Akbarsha, M.A.; Li, A.P.; Kharkar, P.S.; Desai, K.B. In situ allicin generation using targeted alliinase delivery for inhibition of MIA PaCa-2 cells via epigenetic changes, oxidative stress and cyclin-dependent kinase inhibitor (CDKI) expression. Apoptosis 2015, 20, 1388–1409. [CrossRef]
- Zhang, X.; Zhu, Y.; Duan, W.; Feng, C.; He, X. Allicin induces apoptosis of the MGC-803 human gastric carcinoma cell line through the p38 mitogen-activated protein kinase/caspase-3 signaling pathway. Mol. Med. Rep. 2015, 11, 2755–2760. [CrossRef]
- Prager-Khoutorsky, M.; Goncharov, I.; Rabinkov, A.; Mirelman, D.; Geiger, B.; Bershadsky, A.D. Allicin inhibits cell polarization, migration and division via its direct effect on microtubules. Cell Motil. Cytoskelet. 2007, 64, 321–337. [CrossRef]
- Rana, S.V.; Pal, R.; Vaiphei, K.; Sharma, S.K.; Ola, R.P. Garlic in health and disease. Nutr. Res. Rev. 2011, 24, 60–71. [CrossRef]
- 83. Iciek, M.; Kwiecien´, I.; Chwatko, G.; Sokołowska-Jez˙ewicz, M.; Kowalczyk-Pachel, D.; Rokita, H. The effects of garlic-derived sulfur compounds on cell proliferation, caspase 3 activity, thiol levels and anaerobic sulfur metabolism in human hepatoblastoma HepG2 cells. Cell Biochem. Funct. 2012, 30, 198–204. [CrossRef] [PubMed]
- Singh, V.; Belloir, C.; Siess, M.H.; Le Bon, A.M. Inhibition of carcinogen-induced DNA damage in rat liver and colon by garlic powders with varying alliin content. Nutr. Cancer 2006, 55, 178–184. [CrossRef] [PubMed]
- Fleischauer, A.T.; Arab, L. Garlic and cancer: A critical review of the epidemiologic literature. J. Nutr. 2001, 131, 1032s–1040s. [CrossRef] [PubMed]
- Piscitelli, S.C.; Burstein, A.H.; Welden, N.; Gallicano, K.D.; Falloon, J. The effect of garlic supplements on the pharmacokinetics of saquinavir. Clin. Infect. Dis. 2002, 34, 234–238. [CrossRef]
- Bayan, L.; Koulivand, P.H.; Gorji, A. Garlic: A review of potential therapeutic effects. Avicenna J. Phytomed. 2014, 4, 1–14.
- VinayKumar, D.K. Robbins Basic Pathology/[Edited by] Vinay Kumar, Ramzi S. Cotran, Stanley L. Robbins; with Illustrations by James A. Perkins; Saunders: Philadelphia, PA, USA, 2003.
- Dall’Acqua, S.; Maggi, F.; Minesso, P.; Salvagno, M.; Papa, F.; Vittori, S.; Innocenti, G. Identification of non-alkaloid acetylcholinesterase inhibitors from Ferulago campestris (Besser) Grecescu (Apiaceae). Fitoterapia 2010, 81, 1208–1212. [CrossRef]
- Lu, S.H.; Wu, J.W.; Liu, H.L.; Zhao, J.H.; Liu, K.T.; Chuang, C.K.; Lin, H.Y.; Tsai, W.B.; Ho, Y. The discovery of potential acetylcholinesterase inhibitors: A combination of pharmacophore modeling, virtual screening, and molecular docking studies. J. Biomed. Sci. 2011, 18, 8. [CrossRef]
- Akinyemi, A.J.; Lekan Faboya, A.P.; Awonegan, I.O.; Anadozie, S.; Oluwasola, T.A. Antioxidant and anti-Acetylcholinesterase activities of essential oils from garlic (Allium sativum) Bulbs. Int. J. Plant Res. 2018, 31. [CrossRef]
- Singh, P.; Shukla, R.; Prakash, B.; Kumar, A.; Singh, S.; Mishra, P.K.; Dubey, N.K. Chemical profile, antifungal, antiaflatoxigenic and antioxidant activity of Citrus maxima Burm. and Citrus sinensis (L.) Osbeck essential oils and their cyclic monoterpene, DL-limonene. Food Chem. Toxicol. 2010, 48, 1734–1740. [CrossRef]
- 93. Borek, C. Garlic reduces dementia and heart-disease risk. J. Nutr. 2006, 136, 810S–812S. [CrossRef]
- Jackson, R.; McNeil, B.; Taylor, C.; Holl, G.; Ruff, D.; Gwebu, E. Effect of aged garlic extract on human recombinant caspace-3 activity. J. Ala. Acad. Sci. 2003, 74, 121–122.
- Mbyirukira, G.; Gwebu, E.T. Aged garlic extract protects serum-deprived PC12 cells from apoptosis. J. Ala. Acad. Sci. 2003, 74, 127–128.
- Haider, S.; Naz, N.; Khaliq, S.; Perveen, T.; Haleem, D.J. Repeated administration of fresh garlic increases memory retention in rats. J. Med. Food 2008, 11, 675–679. [CrossRef] [PubMed]
- Mukherjee, D.; Banerjee, S. Learning and memory promoting effects of crude garlic extract. Indian J. Exp. Biol. 2013, 51, 1094–1100.
- Kumar, S. Dual inhibition of acetylcholinesterase and butyrylcholinesterase enzymes by allicin. Indian J. Pharmacol. 2015, 47, 444–446. [CrossRef]
- Hogan, D.B. Progress update: Pharmacological treatment of Alzheimer’s disease. Neuropsychiatr. Dis. Treat. 2007, 3, 569–578.
- Schmitt, B.; Bernhardt, T.; Moeller, H.J.; Heuser, I.; Frölich, L. Combination therapy in Alzheimer’s disease. CNS Drugs 2004, 18, 827–844. [CrossRef]
- Weggen, S.; Eriksen, J.L.; Das, P.; Sagi, S.A.; Wang, R.; Pietrzik, C.U.; Findlay, K.A.; Smith, T.E.; Murphy, M.P.; Bulter, T.; et al. A subset of NSAIDs lower amyloidogenic Aβ42 independently of cyclooxygenase activity. Nature 2001, 414, 212. [CrossRef]
- Millard, C.B.; Shnyrov, V.L.; Newstead, S.; Shin, I.; Roth, E.; Silman, I.; Weiner, L. Stabilization of a metastable state of Torpedo californica acetylcholinesterase by chemical chaperones. Protein Sci. 2003, 12, 2337–2347. [CrossRef]
- Inglis, F. The tolerability and safety of cholinesterase inhibitors in the treatment of dementia. Int. J. Clin. Pract. Suppl. 2002, 127, 45–63.
- Jann, M.W.; Shirley, K.L.; Small, G.W. Clinical pharmacokinetics and pharmacodynamics of cholinesterase inhibitors. Clin. Pharmacokinet. 2002, 41, 719–739. [CrossRef] [PubMed]
- 105. Liu, S.G.; Ren, P.Y.; Wang, G.Y.; Yao, S.X.; He, X.J. Allicin protects spinal cord neurons from Glutamate-induced oxidative stress through regulating the heat shock protein 70/inducible nitric oxide synthase pathway. Food Funct. 2015, 6, 321–330. [CrossRef] [PubMed]
- Hosseini, A.; Hosseinzadeh, H. A review on the effects of Allium sativum (Garlic) in metabolic syndrome. J. Endocrinol. Investig. 2015, 38, 1147–1157. [CrossRef] [PubMed]
- Qidwai, W.; Ashfaq, T. Role of garlic usage in cardiovascular disease prevention: An evidence-based approach. Evid. Based Complement. Altern. Med. 2013, 2013, 125649. [CrossRef]
- Iweala, E.E.; Akubugwo, E.I.; Okeke, C.U. Effect of ethanolic extracts of Allium sativum Linn. Liliaceae on serum cholesterol and blood sugar levels of alibino rabbits. Plant Prod. Res. J. 2005, 9, 14–18.
- Campbell, J.H.; Efendy, J.L.; Smith, N.J.; Campbell, G.R. Molecular basis by which garlic suppresses atherosclerosis. J. Nutr. 2001, 131, 1006S–1009S. [CrossRef]
- Sobenin, I.A.; Nedosugova, L.V.; Filatova, L.V.; Balabolkin, M.I.; Gorchakova, T.V.; Orekhov, A.N. Metabolic effects of time-released garlic powder tablets in type 2 diabetes mellitus: The results of double-blinded placebo-controlled study. Acta Diabetol. 2008, 45, 1–6. [CrossRef]
- Sobenin, I.A.; Pryanishnikov, V.V.; Kunnova, L.M.; Rabinovich, Y.A.; Martirosyan, D.M.; Orekhov, A.N. The effects of time-released garlic powder tablets on multifunctional cardiovascular risk in patients with coronary artery disease. Lipids Health Dis. 2010, 9, 119. [CrossRef]
- Ashraf, R.; Aamir, K.; Shaikh, A.R.; Ahmed, T. Effects of garlic on dyslipidemia in patients with type 2 diabetes mellitus. J. Ayub. Med. Coll. Abbottabad. 2005, 17, 60–64.
- Patel, D.K.; Prasad, S.K.; Kumar, R.; Hemalatha, S. An overview on antidiabetic medicinal plants having insulin mimetic property. Asian Pac. J. Trop. Biomed. 2012, 2, 320–330. [CrossRef]
- Faroughi, F.; Mohammad-Alizadeh Charandabi, S.; Javadzadeh, Y.; Mirghafourvand, M. Effects of garlic pill on blood glucose level in borderline gestational diabetes mellitus: A triple blind, randomized clinical trial. Iran. Red. Crescent Med. J. 2018, 20, e60675. [CrossRef]
- Zhai, B.; Zhang, C.; Sheng, Y.; Zhao, C.; He, X.; Xu, W.; Huang, K.; Luo, Y. Hypoglycemic and hypolipidemic effect of S-allyl-cysteine sulfoxide (alliin) in DIO mice. Sci. Rep. 2018, 8, 3527. [CrossRef] [PubMed]
- Lee, M.S.; Kim, I.H.; Kim, C.T.; Kim, Y. Reduction of body weight by dietary garlic is associated with an increase in uncoupling protein mRNA expression and activation of AMP-activated protein kinase in diet-induced obese mice. J. Nutr. 2011, 141, 1947–1953. [CrossRef] [PubMed]
- Han, C.Y.; Ki, S.H.; Kim, Y.W.; Noh, K.; Lee da, Y.; Kang, B.; Ryu, J.H.; Jeon, R.; Kim, E.H.; Hwang, S.J.; et al. Ajoene, a stable garlic by-product, inhibits high fat diet-induced hepatic steatosis and oxidative injury through LKB1-dependent AMPK activation. Antioxid. Redox Signal. 2011, 14, 187–202. [CrossRef]
- Keophiphath, M.; Priem, F.; Jacquemond-Collet, I.; Clément, K.; Lacasa, D. 1,2-Vinyldithiin from garlic inhibits differentiation and inflammation of human preadipocytes. J. Nutr. 2009, 139, 2055–2060. [CrossRef]
- 119.Varshney, R.; Budo ff, M.J. Garlic and Heart Disease. J. Nutr. 2016, 146, 416S–421S. [CrossRef]
- Drobiova, H.; Thomson, M.; Al-Qattan, K.; Peltonen-Shalaby, R.; Al-Amin, Z.; Ali, M. Garlic increases antioxidant levels in diabetic and hypertensive rats determined by a modified peroxidase method. Evid. Based Complement. Altern. Med. 2011, 2011, 703049. [CrossRef]
- Sobenin, I.; Andrianova, I.; Ionova, V.; Karagodin, V.; Orekhov, A. Anti-aggregatory and fibrinolytic effects of time-released garlic powder tablets. Med. Health Sci. J. 2012, 10, 47–51. [CrossRef]
- Dubey, H.; Singh, A.; Patole, A.M.; Tenpe, C.R. Antihypertensive effect of allicin in dexamethasone-induced hypertensive rats. Integr. Med. Res. 2017, 6, 60–65. [CrossRef]
- Ried, K.; Fakler, P. Potential of garlic (Allium sativum) in lowering high blood pressure: Mechanisms of action and clinical relevance. Integr. Blood Press. Control 2014, 7, 71–82. [CrossRef]
- Rahman, K.; Lowe, G.M.; Smith, S. Aged garlic extract inhibits human platelet aggregation by altering intracellular signaling and platelet shape change. J. Nutr. 2016, 146, 410S–415S. [CrossRef] [PubMed]
- 125.Tattelman, E. Health e ffects of garlic. Am. Fam. Physician 2005, 72, 103–106. [PubMed]
- Asdaq, S.M.B.; Inamdar, M.N. The potential benefits of a garlic and hydrochlorothiazide combination as antihypertensive and cardioprotective in rats. J. Nat. Med. 2011, 65, 81–88. [CrossRef]
- Piasek, A.; Bartoszek, A.; Namiesnik, J. Phytochemicals that counteract the cardiotoxic side effects of cancer chemotherapy. Postepy Hig. Med. Dosw. 2009, 63, 142–158.
- Salgado, B.; Monteiro, L.; Rocha, N. Allium species poisoning in dogs and cats. J. Venom. Anim. Toxins Incl. Trop. Dis. 2011, 17, 4–11. [CrossRef]
- 129. Lee, L.S.; Andrade, A.S.; Flexner, C. Interactions between natural health products and antiretroviral drugs: Pharmacokinetic and pharmacodynamic effects. Clin. Infect. Dis. 2006, 43, 1052–1059. [CrossRef]
- Borrelli, F.; Capasso, R.; Izzo, A.A. Garlic (Allium sativum L.): Adverse effects and drug interactions in humans. Mol. Nutr. Food Res. 2007, 51, 1386–1397. [CrossRef]
- Chen, K.; Xie, K.; Liu, Z.; Nakasone, Y.; Sakao, K.; Hossain, A.; Hou, D.X. Preventive effects and mechanisms of garlic on dyslipidemia and gut microbiome dysbiosis. Nutrients 2019, 11, 1225. [CrossRef]
- Yuncu, M.; Eralp, A.; Celik, A. Effect of aged garlic extract against methotrexate-induced damage to the small intestine in rats. Phytother. Res. 2006, 20, 504–510. [CrossRef]
- Almogren, A.; Shakoor, Z.; Adam, M.H. Garlic and onion sensitization among Saudi patients screened for food allergy: A hospital-based study. Afr. Health Sci. 2013, 13, 689–693. [CrossRef]
- Mohammadi, A.; Vafaei, S.A.; Moradi, M.N.; Ahmadi, M.; Pourjafar, M.; Oshaghi, E.A. Combination of ezetimibe and garlic reduces serum lipids and intestinal niemann-pick C1-like 1 expression more effectively in hypercholesterolemic mice. Avicenna J. Med. Biochem. 2015, 3, e23205. [CrossRef]
- Liu, M.Z.; Zhang, Y.L.; Zeng, M.Z.; He, F.Z.; Luo, Z.Y.; Luo, J.Q.; Wen, J.G.; Chen, X.P.; Zhou, H.H.; Zhang, W. Pharmacogenomics and herb-drug interactions: Merge of future and tradition. Evid. Based Complement. Altern. Med. 2015, 2015, 321091. [CrossRef] [PubMed]
- Badr, G.M.; Arafa, N.S. Synergetic effect of aged garlic extract and methotrexate on rheumatoid arthritis induced by collagen in male albino rats. Indian J. Exp. Biol. 2020, 58, 33–38.
- Ismail, R.M.; Saleh, A.H.A.; Ali, K.S. GC-MS analysis and antibacterial activity of garlic extract with antibiotic. J. Med. Plants Stud. 2020, 8, 26–30.
- Vathsala, P.G.; Murthy, P.K. Immunomodulatory and antiparasitic effects of garlic–arteether combination via nitric oxide pathway in Plasmodium berghei-infected mice. J. Parasit. Dis. 2019, 49–61. [CrossRef] [PubMed]
- Beshbishy, A.M.; Batiha, G.E.-S.; Alkazmi, L.; Nadwa, E.; Rashwan, E.; Abdeen, A.; Yokoyama, N.; Igarashi, I. Therapeutic effects of atranorin towards the proliferation of Babesia and Theileria parasites. Pathogen 2020, 9,

